- HOME
- がん免疫療法
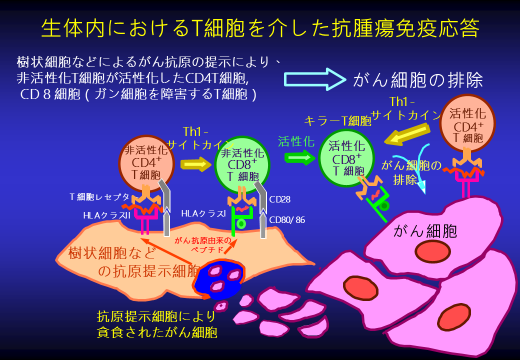
がん免疫のメカニズム
自家がんワクチン療法はこの部分を活性化します
獲得免疫
抗原提示細胞(樹状細胞など) T細胞 細胞性免疫
自然免疫
B細胞 体液性免疫 NKT細胞 NK細胞
当院では以下のがん免疫療法を施行しております。以下に費用と治療内容を示します。
1.自家がんワクチン療法
自家がんワクチン療法とは・・・がん免疫療法の一つです。手術で取り出された患者様ご自身のがん組織から、がんワクチンを作製し、がんと闘う体内のリンパ球を活性化する治療法です。手術で取りだされ、ホルマリン漬けにされたがん組織、またはパラフィン(ろうそくの蝋のことです)に埋め込まれ「パラフィン包埋ブロック」に加工されたがん組織が、約2gあれば(大人の小指の1/3程度の大きさです)、原料として使用できます。手術をうけられた病院に問い合わせれば、患者様のがん組織が残っているかどうかがわかります。
特徴
手術後の再発防止、転移予防、体内に残存しているがんの治療が期待できます。もし、放射線治療と併用できる状態の方であれば、併用によりなお一層治療効果が期待できます。
(1)事前のテストの注射1回と判定、(2)ワクチン注射(通常は隔週ごとに計3回)、(3)事後のテストの注射1回と判定、で1クールです。(3)は省略する場合もあります。通常は1クールの治療で終了します(長くても約6週間です)。延々と繰り返す必要はありません。
1クールで約165万円(税込み)です。詳細は当院にお問い合わせください。
主なリスクと副作用
国内で報告されている副作用としては、抗がん剤のように白血球が激減したり、髪が抜ける等の強い副作用はありません。自家がんワクチンを注射したところの一時的な腫れや1~2日程度の発熱はありますが、いずれも自然に治っていく範囲で、大きな問題になるほどのものではありません。
詳しくは、こちらをクリックしてご覧ください。 →http://cell-medicine.com
下記のごとく、国内の大学病院にて臨床治験の段階ですので、国内外ともに医薬品としてはまだ未承認の治療方法となります。自家がんワクチンと同一の成分や性能を有する他の国内国外ともに承認医薬品はありません。当然、諸外国で使用されておりません。このため国外では使用されていませんが、重大なリスクが明らかになっていない可能性があります。
但し、現在脳腫瘍の中の初発膠芽腫を対象とした治験が施行されています。この治験は、初めて(初発の)膠芽腫と診断された患者様のうち、一定の基準を満たした方が対象となります。参加された場合は、治験薬は無償となります。治験受けられる場合は、ランダム化して治験希望の患者様に、プラセボ(偽薬:生理食塩氏など)と実際の自家がんワクチンが投与されるため、必ず自家がんワクチンによる治療を受けられるというわけにはなりません。当院では治験を行うわけではありませんので、ご希望の患者様には、ご自身のがん組織から作製された自家がんワクチンを投与いたします。
この治験の基準等は、こちら
治験の目的:初発膠芽腫に対する治験薬の有効性、安全性を検討する。
治験の代表医師:東京女子医科大学 先端生命医科学研究所/脳神経外科 村垣善浩 教授
(共同代表医師):筑波大学 脳神経外科 石川栄一 准教授
治験実施医療機関:(全国で11の大学病院が参加しています)
- 北海道大学病院(連絡先:011-706-5779(脳神経外科外来))
- 東北大学病院(連絡先:022-717-7752 (脳神経外科外来)、担当医師:金森政之)
- 筑波大学附属病院(連絡先:029-853-3545、担当者:西谷明子)
- 東京女子医科大学病院(連絡先:03-3353-8112(内線:)、担当医師:田村学)
- 横浜市立大学附属病院(連絡先:045-787-2800、担当医師:脳神経外科・三宅勇平)
- 山梨大学医学部附属病院(連絡先:055-273-9325 臨床研究連携推進部【治験センター】)
- 京都大学医学部附属病院(連絡先:075-751-3459(脳神経外科・医局)、担当医師:荒川芳輝)
- 神戸大学医学部附属病院(連絡先:078-382-5966(脳神経外科医局)、担当医師:田中一寛)
- 佐賀大学医学部附属病院(連絡先:0952-34-2346(脳神経外科医局)、担当医師:阿部竜也)
- 久留米大学病院(連絡先:0942-31-7570(脳神経外科・医局)、担当医師:中村英夫)
- 熊本大学病院(連絡先:096-373-5602、担当医師:脳神経外科、武笠晃丈)
2.丸山ワクチン療法
40日分で1万1,000円(税込)
日本医科大学ワクチン療法施設より、ワクチンをご購入いただきます。手続きにつきましては当院にて説明いたします。日本医科大学にて説明をきいていただき(SSM(丸山ワクチン)の初回登録手続きは通常来院受付後DVDによる概要説明をご覧頂き、医師との個別面談の後に治験薬の交付を行っております。今般の新型コロナウイルス感染拡大防止のため交通機関による国内移動や免疫機能低下による来院が困難な状況も予想されることから、初回の登録におきましても郵送での手続きを可能とされています。)、同大学から購入後ワクチンを当院に持参していただければ1日おきに皮内注射を行います。当院での費用は通常診察料のみです。)
丸山ワクチンは有償治験とされています。有償治験薬とは、開発された新薬を厚生労働省が承認するのに十分な要件(有効性があるか、副作用はないかなど)を備えているかどうかを、一定の条件(病名、病状、併用薬など)に適合した実際の患者さんに使ってテストすることです。いわば実験ですから、治験薬は本来無料で提供されます。しかし丸山ワクチンは、限定された方だけではなく、希望されたガン患者さんはどなたでも使うことができます。この点から、特例として1981年厚生省(当時)は、実費を患者さんに負担して協力していただく治験薬=有償治験薬ということを認めました。現在のところ有償試験中であり、国内外ともに医薬品としてはまだ未承認の治療方法となります。当然、諸外国で使用されておりません。このため国外では使用されていませんが、重大なリスクが明らかになっていない可能性があります。
効果としましては丸山ワクチンホームページに詳細は記載されております。作用を簡単にまとめますと根治手術不能胃がんの患者さまに化学療法単独の5年生存率と比較し、化学療法に丸山ワクチンを併用すると50カ月後の生存率が15.2%高かったことが報告(1983年)されています。2016年2月現在、丸山ワクチンは大規模臨床試験の段階に入っています。1992年にJGOG(婦人科悪性腫瘍研究機構)がゼリア新薬工業から、丸山ワクチンの有効性を調べる臨床試験を依頼されたていました。子宮頚癌III期の患者を対象に調べたところ、濃度を40µgの最大にした注射液が、腫瘍縮小率に優れていた。そこで丸山ワクチン40µg液を使った場合の患者の生存率を、二重盲検試験で調べることになり、プラセボ(偽薬)の代わりとして、濃度を極めて薄くした丸山ワクチンB液(濃度0.2µg)を使った。丸山ワクチン40µg液(国内承認薬であるアンサー20と全く同成分です)は41.5%でプラセボ代わりの0.2µg液(B液)を使った患者は58.2%で、丸山ワクチン40µg液の5年生存率が10%以上悪いという結果でした。2004年からはB液を対象とした臨床試験を実施した。放射線療法+丸山ワクチンB液と、放射線療法+プラセボの二重盲検試験である。これで5年生存率を調べたところ、前者が75.7%、後者が65.8%という数字が報告されています。ただし、臨床試験の期間において医療機関に放射線化学療法が導入されて患者の予後が予想以上に良くなったこと、病期II期の患者数が想定していたよりも多かったことなどから、統計学的には有意差を認めるに至りませんでした。しかし、臨床的には意味のある結果であったことから(論文「Phase III placebo-controlled double-blind randomized trial of radiotherapy for stage IIB–IVA cervical cancer with or without immunomodulator Z-100: a JGOG study」(2014)の endpointでThe estimated total sample size was 240 to detect an 18% increase in the 5-year survival rateとの結果を得ている)、この試験にたずさわった埼玉医科大学国際医療センター婦人科腫瘍科教授・藤原恵一らが、2013年6月のASCO(米国臨床腫瘍学会)において、丸山ワクチン(試験薬剤コード名:Z-100)の試験データを報告されています(Sugiyama T, Fujiwara K, Ohashi Y, Yokota H, Hatae M, Ohno T et al. (2014). “Phase III placebo-controlled double-blind randomized trial of radiotherapy for stage IIB-IVA cervical cancer with or without immunomodulator Z-100: a JGOG study.”. Ann Oncol 25 (5): 1011-7.)。
国内での承認状況
同成分の薬剤として放射線療法による白血球減少症の治療薬として、1991年に国内承認された「アンサー20レジスタードマーク」(結核菌熱水抽出物・ゼリア新薬工業)は、丸山ワクチンと同成分です。アンサー20が効果ありとされた白血球減少症は、悪性腫瘍によって引き起こされる症状、あるいは、その化学療法や放射線療法時の副作用への対策薬です。この作用としては国内にて承認をうけています。アンサー20は丸山ワクチン液A液の10倍の濃度です。丸山ワクチンB液は、同A液の10分の1の濃度です。つまり丸山ワクチンはがん治療としての国内外での承認はありませんが、白血球減少症としては承認を受けているアンサー20と同成分の薬剤です。このように紆余曲折がありますが、丸山ワクチンは、現在のところ抗がん剤として承認されたわけではありません。またがん治療目的としては、丸山ワクチンは国内、国外とも未承認薬です。当然、諸外国で使用されておりません。
主なリスクと副作用
[同内容である国内承認薬である「アンサー20」では、副作用発現状況の概要]
総症例322例中15例(4.7%)に臨床検査値の変動を含む副作用が報告されています。その主なものは,注射部位の発赤,腫脹,硬結,水疱形成及び疼痛の適用部位障害3.0%,湿疹及び発疹等の過敏症状0.9%でした。臨床検査値ではALT(GPT)上昇0.9%,AST(GOT)上昇0.3%,LDH上昇0.3%及びAl-P上昇0.3%がみられました。(承認時)
☆規制区分名称 : 生物由来製品
規制区分: 処方箋医薬品注)日本標準商品分類番号 : 873399 承認番号 : 21900AMX01155000 薬価基準収載年月 : 2007年12月 販売開始年月 : 1991年9月
丸山ワクチンの副作用としては、それ自体が結核菌の成分で、結核菌そのものではありませんので、大きな副作用は報告されていません。丸山ワクチンの一種である、悪性腫瘍に対する放射線療法の際に生じる白血球減少症に対する治療薬であるZ-100原液(アンサー20)では、注射部位に腫れが報告されています。
3.内服薬を用いたがん免疫療法
1:セファランチン内服(健康保険にて処方可能です)
最近の研究で、がん細胞の増殖を抑制する作用やアポトーシスを誘導する作用、血管新生阻害作用など、がん治療における効果が報告されています。放射線治療中は保険適用となりますが、安価な薬剤ですので1カ月分で保険外診療でも5,000円程度です。
2:漢方薬内服(健康保険にて処方可能です)
【十全大補湯】
1:十全大補湯は進行性膵がん患者で抗腫瘍免疫を抑制する制御性T細胞数を減少させる。このことは膵がんでのさまざまな併用療法を行った際に良好な免疫賦活作用につながる可能性があるとされています。
2:十全大補湯それ自身に、がんの発生や再発の予防する作用や、転移を抑制する作用があることが報告されています。富山医科薬科大学和漢薬研究所の報告では十全大補湯が、がん細胞の悪性化進展や転移を抑制することを報告しています。
【補中益気湯】
老化に伴う抗腫瘍免疫の低下を改善させることや、真菌や細菌に対する感染防御力を高めることなど、多くの実験結果からも支持されています。
4.がん代替治療
1:フコイダン内服
1996年の日本癌学会にて、フコイダンががん細胞に働きかけてアポトーシス(がん細胞を自殺させる)現象を誘導することが報告されています。低分子型や高分子型などのさまざまなものがインターネットなどで販売されています。どのフコイダンが有効か悩まれている患者さまがおられましたら、ご相談ください。論文に基づき有効性が証明されているフコイダンを説明いたします。
2:高濃度ビタミンC療法
上記のようながん代替療法を含めた、がん免疫療法を患者さまごとに、費用対作用を相談しながら治療のお手伝いをさせていただきます。また上記のような治療を併用しながら、健康保険が適用とされ、がんに対する有効性のエビデンスが確立されているがん温熱療法を受けていただくことをお勧めいたします。
